研究内容
1.ゲノムをベースにしたコムギの遺伝育種科学に関する研究
コムギはイネやトウモロコシと並ぶ世界の三大穀物の一つであり、人口増加や気候変動に対応して食料の安定供給を図るために重要な作物です。また、3つの野生種が交雑して成立した結果、1つの細胞の中に3つのゲノムを持つ異質倍数性を示すなど基礎応用の両面から興味深い材料です。
異質倍数性によるゲノムの複雑さに加えて、イネの40倍にも及ぶ巨大なゲノムサイズから、コムギのゲノム解析は遅れていましたが、2018年に国際コンソーシアムによってコムギのゲノム配列の全容が明らかになりました。私たちは、これまでの遺伝育種学研究の蓄積に新しいゲノム情報を付加することで研究をより一層発展させ、コムギの生産性向上を目指した新しい育種システム構築の基盤を作っていきたいと考えています。
1)コムギのゲノム多様性に関する研究
世界のコムギ研究者が共同して組織した国際コムギゲノム解読コンソーシアム(IWGSC)に参加してコムギのゲノム解読を進め、2018年にコムギ初の参照ゲノム配列を発表しました。さらに、コムギの持つ遺伝的多様性を明らかにするために、世界のさまざまな地域のコムギ品種のゲノムを解読して比較解析しようとするThe 10+ Wheat Genomes Projectに参加し、高温多湿というコムギにとって特殊な環境条件に適応する形で進化してきた日本のコムギ品種のゲノムを解読し、コムギの環境適応の進化を明らかにしようと、横浜市立大学や京都大学と共同で研究を進めています。
2)コムギの倍数性進化に関する研究
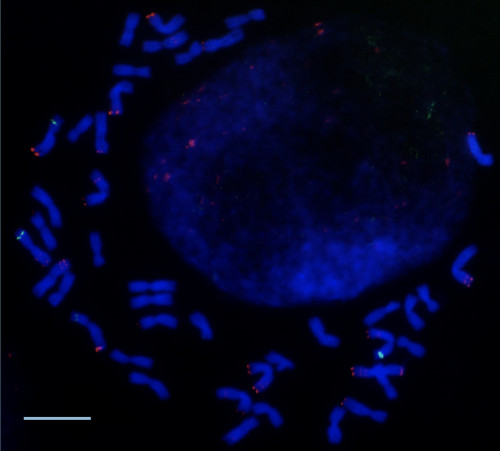
コムギの異質倍数化においては、これまで独立していた別個のゲノムが、一つの細胞中に共存する形になり、倍数種の成立・安定化には、倍数化の過程でのゲノム間の調和が必要になります。雑種後代において、両親の染色体上にあるNOR領域のうち、どちらか一方の親から受け継がれた染色体上にあるものだけが機能を持つという現象がNucleolar Dominanceであり、ゲノム間の調節機構の一つと考えられます。コムギのNOR領域におけるNucleolar Dominanceを調べることで、倍数性進化の過程でゲノムに何が起こったのかを明らかにしようとしています。
3)コムギ及びオオムギの出穂制御機構に関する研究
シロイヌナズナやイネ等のモデル植物での花成制御研究により、CO-FTといった基幹的な遺伝子ネットワークは植物種に共通であることが知られています。しかし、それ以外にさまざまな種特異的な遺伝因子により、花成(出穂)が精密に制御されていることが明らかになってきています。長日植物であるコムギやオオムギのムギ類を材料に、近縁ではあるけれど短日植物であるイネと比較しながら、さまざまな花成(出穂)関連遺伝子群の単離や発現解析等を通じて、ムギ類特異的な出穂制御遺伝子ネットワークの解明を目指しています。
2.ゲノム編集等による新たな花色・草姿の作出と有用形質の実用化研究
1)植分子育種技術を利用した作物の効率的な形質改変の研究
◯ ゲノム編集を用いた花きを自在に八重化する技術の開発
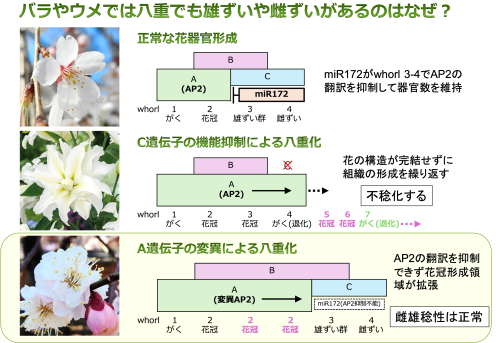
花弁数は花卉の重要形質であり,様々な園芸植物で八重品種の開発が行われてきました。花器官形成に関わるABCモデルのクラスA遺伝子(AP2遺伝子)にゲノム編集によって変異を導入することで,稔性を損なわずに八重化させる技術の開発を進めています。この八重化変異は顕性変異で生殖機能が正常であることから育種母本としての有用性が高く,F1品種の親系統としての実用性を調査しています。また,取得したゲノム編集系統の解析により,バラやウメなどにみられる不稔化しないメカニズムの解明を進めます。
◯ 花弁の質感を制御する仕組みの解明と利用
花卉の重要形質の一つである質感は,大きさ,形,色,配色パターンなどに比べて重要視されてきませんでしたが,近年の研究から花弁表皮細胞の形状や細胞内での色素分布によって大きく変化することがわかってきました。これに関わる遺伝子をCRES-T法などを用いて同定するとともに,これを積極的に利用する技術と質感の評価手法の研究を進めています。通常は円錐形であるトレニア花弁表皮細胞の基部をドーム状に変形させることでビロード状の質感を付与する遺伝子の候補を絞り込み,その本来の機能を解析するとともに,他の植物種への適用可能性を検討し,汎用性の高い花弁質感改変技術として確立します。
2)分子育種技術の実用化にかかる周辺技術の研究
◯ 植物への遺伝子導入を効率化する技術の開発
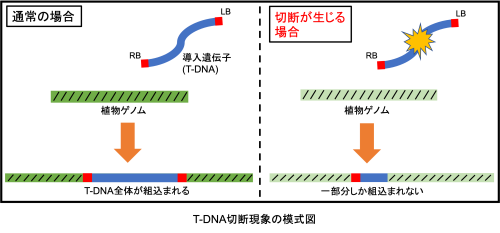
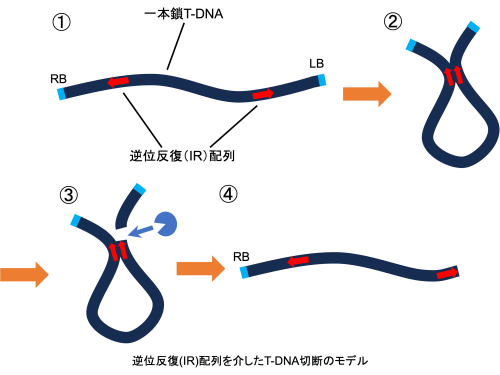
遺伝子組換えやゲノム編集といった分子育種技術を利用するためには、目的の遺伝子を植物に導入する(=形質転換する)必要があります。この植物への形質転換技術として最も利用されているのがアグロバクテリウム法です。この手法では土壌細菌であるアグロバクテリウムを植物に感染させることで、目的の導入遺伝子(=T-DNA)を植物のゲノムに組込むことができます。簡便かつ安価で形質転換を行えるという理由で広く利用されている手法ですが、このT-DNAが導入途中で切断されてしまい、一部だけしか組込まれないという現象が多くの植物種で報告されています(図1)。当研究室ではこの切断が高頻度で生じるポインセチアの種間雑種、‘プリンセチア’という植物を対象に切断現象の原因解明に取り組んでいます(図2)。これまで行ったシーケンス解析などの結果から、T-DNA上の逆位反復(IR)配列を介して切断が引き起こされる可能性を明らかにし、切断メカニズムのモデルを作製しました(図3)。今後は‘プリンセチア’の親系統でも切断が高頻度で生じる可能性が報告されているため、切断の種特異性が何に起因するかについても調査していきます。
◯ 培養物長期維持を目的とした植物培養用培地の最適化
花卉や野菜などの多くは遺伝的に純化れておらず,後代での遺伝的特性にばらつきが出てしまうため,高品質の維持や研究用途での利用には栄養増殖での維持が必要です。そのため,多数系統の植物を扱う場合はそのコストと労力が大きな負担となります。植物の培養では一般にスクロースが用いられますが,トレニアやキクではこれをトレハロースに置き換えることで,2.5倍〜10倍にも継代間隔を延長できることがこれまでに明らかになっています。さらに,このトレハロースの濃度を最適化することで植物の活性を下げずにより長期間培養物を維持できることがわかってきました。下記の昆虫由来生理活性物質の併用なども検討しながら培養物のさらなる長期維持手法を開発し,凍結保存法などの煩雑で高コストなプロセスを伴わず,増殖活性の高い植物材料を常時供給できる保存技術として確立します。
◯ 植物形質転換系の改良に向けたタンパク質高発現ベクター利用技術の開発(奈良先端大との共同研究)
「光る花」作出等の技術基盤となったタンパク質高発現ベクターを利用して,難形質転換植物種への遺伝子導入における選抜効率の大幅な向上を図ります。これまで高発現の対象としてきた目的形質にかかる遺伝子に加え,選抜マーカー遺伝子を高発現させることで,アグロバクテリウムとの共存や薬剤選抜のストレス条件下でも安定な形質転換細胞の選抜を実現します。これにより,各種植物でのより幅広い選抜マーカーの選択肢を提供するとともに,エスケープ(非組換え体が選抜で生き残ってしまうこと)の排除などによる既存手法の効率向上に資する技術として確立します。
◯ ウイスカー法を用いた作物等の植物形質転換系の確立(インプランタイノベーションズとの共同研究)
微細な針状結晶を用いて物理的に遺伝子を導入することで,植物種を問わず遺伝子導入を可能とする手法として期待されるウイスカー法を花卉や野菜など広範囲の作物種に適用し,実用化を視野に入れた分子育種の基盤を拡充します。
◯ ゲノム編集・遺伝子組換え技術の国民理解促進に向けた発信手法の研究
上記手法で作出した様々な花卉等を用いて樹脂封入標本教材やパブリックスペース向けの展示物を企画・開発する一方,これらを遺伝子組換え生物等規制法(通称カルタヘナ法)のもとで正しく利用するための技術開発を行います。具体的には,植物体の外観を損なわずに花粉等を不活化する手法や不活化状態の確認方法の開発,展示用ケースの開発,関連省庁規制担当部局との調整作業などを行います。
3)植物の成長・増殖や物質生産に繋がる新たな技術の開発(虫こぶ形成昆虫の持つ植物生理活性の解明と利用技術の開発)
◯ 難培養性植物の組織分化や増殖の促進にかかる技術開発
これまで研究開発の素材として利用が難しかった幅広い植物種で,組織培養や大量増殖を可能とし,変異体作成,遺伝子導入,ゲノム編集など分子レベルでの技術適用と形質改変効率の向上を目指します。例えば,地域特産の高付加価値農産物(伝統野菜など)のうち,これまでに組織培養・増殖系が確立されていなかったものについて新たな種苗生産手法や短期育成技術を開発します。これにより,農業生産の効率化や植物工場適性の改良などを通じた新規生産体系の構築を目指します。また,プロトプラストや培養細胞の分裂,増殖,植物体再生を効率化することで,これまでは扱いの難しかった植物への遺伝子導入,ゲノム編集技術の適用が可能となり,新奇な高付加価値農作物の開発が期待されます。
◯ マンデビラ(Mandevilla)の組織培養と形質転換
マンデビラはキョウチクトウ科の夏に大きな花を付ける園芸植物です。近年市場のニーズに伴い,より豊かな花色や耐病性などの形質を持つ品種の作出が望まれています。そのため,遺伝子組換えやゲノム編集による新品種の作出に向け,分子育種の技術基盤となる組織培養系の確立に需要があります。本研究室ではマンデビラの組織培養系の確立に向け,培地組成などの条件検討およびアグロバクテリウム法による形質転換方法の検討を行っています。
◯ 虫こぶ寄主植物の組織培養と形質転換手法の確立
虫こぶを形成する寄生昆虫が,寄主植物の形態や生理的機構を巧みに操る能力は,植物の形質改変や有用物質生産に活用できる可能性があります。しかし,虫こぶ形成のメカニズムには未解明な点が多く,特に虫こぶ形成のモデル系が未確立であることが大きな障壁となっています。寄主植物の機能改変を目的として,虫こぶ形成植物であるヌルデやシラヤマギク,ヨモギ等の培養系,および形質転換系の開発に取り組んでいます。特にヌルデでは,アグロバクテリウム法による効率的な形質転換条件の確立に成功しました。この手法を基盤として,虫こぶ形成のメカニズム解明に向けた研究も推進していきます。